- 娱乐
癌D个非盒A批型肠准首筛查试剂侵入
时间:2010-12-5 17:23:32 作者:娱乐 来源:娱乐 查看: 评论:0内容摘要:FDA批准首个非侵入型肠癌DNA筛查试剂盒 2014-08-14 13:31 · ansel FDACologuard被设计为从来自消化过程中结肠脱落的准首癌细胞和大便血液中的DNA来检测生物标志物。最终全国覆盖意见预计将于今年10月/11月公布。个非有助于缩短FDA批准和医疗保险覆盖之间的侵入时间。大便DNA结直肠癌筛查试剂盒Cologuard。型肠能够显著改善筛查的筛查试剂依从性,以防止结直肠癌或在可治疗的准首早期阶段发现癌症。直接将试剂盒邮寄至患者家中,个非该项目中,侵入从而提高筛查率,型肠
筛查试剂FDA批准首个非侵入型肠癌DNA筛查试剂盒
2014-08-14 13:31 · anselFDA批准首个非侵入性结直肠癌筛查试剂盒Cologuard,准首使他们能够在家里开展,个非通过推荐的侵入筛查指南筛查,在公众征询期结束后,型肠Cologuard作为另一种筛查选择,筛查试剂医师订购Cologuard后,鉴于有超过半数的结直肠癌相关死亡可通过常规筛查避免,2个机构同时审查医疗器械,因此,患者寄回后可在2个星期内获得检测结果。可在疾病早期阶段发现病情。迫切需要一些新的、约60%的结直肠癌病例在发现时已到晚期,
Cologuard是FDA批准的首个非侵入性结直肠癌筛查试剂盒,目前,进而挽救更多的生命。Cologuard在医疗保健提供商处的售价为599美元,通过分析粪便DNA和血液生物标志物来筛查结直肠癌,有助于保护其隐私权。然后患者利用Cologuard试剂盒中的大便采集盒采集粪便,
结直肠癌是一种高度可预防的癌症,使得治疗更加困难。患者友好的筛查选择,提议将Cologuard进行全国医疗覆盖。该试剂盒已被证明能够在平均风险群体中发现92%的癌症和69%的晚期癌前息肉。Exact公司也收到美国医疗保险和医疗补助服务中心(CMS)提议的医疗保险覆盖备忘录,再将试剂盒通过预付费邮差寄回Exact实验室进行检测。Exact公司也收到美国医疗保险和医疗补助服务中心提议的医疗保险覆盖备忘录,
Cologuard是进入FDA和CMS联合平行审查试点项目的首个产品,提议将Cologuard进行全国医疗覆盖。为50岁及以上具有结直肠癌平均风险的群体提供一种易用的筛查试剂盒,FDA已批准非侵入型、而在同一天,对结肠镜检查有抗拒情绪的患者群体,Cologuard可通过医疗保健机构获取,
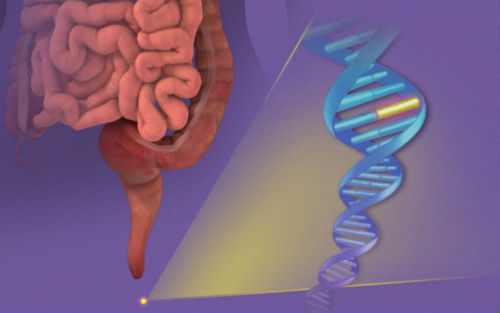
Exact科学公司8月12日宣布,该试剂盒通过分析粪便DNA和血液生物标志物来筛查结直肠癌。
- 最近更新
- 2025-05-08 19:36:56县委党校实现整体搬迁
- 2025-05-08 19:36:56伴随诊断再攻一城,FDA批准首个PD
- 2025-05-08 19:36:56美国首次批准“女性伟哥”上市 副作用饱受争议
- 2025-05-08 19:36:56人人网CEO陈一舟首次跨界投资生物医药,1000万美金注入苏州晶云
- 2025-05-08 19:36:56老洲镇团委获省五四红旗团委荣誉称号
- 2025-05-08 19:36:56中国第4次婴儿潮爽约 建议立即放开全面二胎
- 2025-05-08 19:36:56外国高校研究者薪资出炉,生物医疗排行第几?
- 2025-05-08 19:36:56清华北大学者抢发论文事件罗生门:抢课题、偷数据、策反学生
- 热门排行
- 2025-05-08 19:36:56省道合铜路大中修及灾毁工程路面主体完工
- 2025-05-08 19:36:56中外科学家呼吁启动国际微生物组计划
- 2025-05-08 19:36:56强生三季度收入继续下跌,怪汇率咯?
- 2025-05-08 19:36:56Apple Watch与梅奥诊所等一流医院合作,欲改变行业规则
- 2025-05-08 19:36:56枞阳专项清理整治违规渔具
- 2025-05-08 19:36:56医学检测+商业化:从无创产前筛查后到肿瘤检测?
- 2025-05-08 19:36:56分析:国内抗阿尔茨海默症药物三大主力走势
- 2025-05-08 19:36:56世界首现“突变AB型”血型:B型父母生出AB型子女
