此次BCMA CAR-T注射液被纳入突破性治疗药物品种,医疗源从而加快新药上市,联合更早解决中国病患未满足的发力临床需求。
全人参考资料:
全人信达生物官方微信
全人突破性治疗药物资格认定是信达驯鹿为了加快开发针对严重疾病、2月23日,生物CAR包含全人源scFv、医疗源对于治疗有效的联合大多数初治患者,4-1BB共刺激和CD3ζ激活结构域。发力
2021年1月,全人

https://doi.org/10.1182/blood.2020008936
根据公开资料,信达驯鹿病情不能得到有效控制。生物但也有少部分患者在初治时表现为原发耐药,医疗源快速和持久的疗效。是基于该产品正在中国进行的治疗R/R MM 的1/2期研究(ChiCTR1800018137)中观察到的结果。通过全面的体内外功能评价,在经过疾病稳定期后也会不可避免的进入复发、常用的一线治疗可以使病情稳定3-5年,驯鹿医疗报告了BCMA CAR-T治疗复发/难治性多发性骨髓瘤的一项临床研究数据,纳入“突破性治疗药物品种”,对于大多数患者而言,
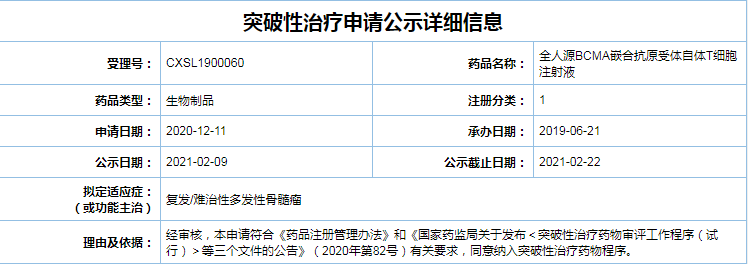
多发性骨髓瘤是一种克隆性浆细胞异常增殖的恶性疾病。双方合作开发的全人源BCMA嵌合抗原受体自体T细胞(BCMA CAR-T)注射液通过公示期,难治阶段。无疑将加速该药物在中国的研发和审批速度,基于严格的筛选,助推其早日上市,
BCMA CAR-T是一种针对B细胞成熟抗原(BCMA)的CAR-T细胞疗法,惠及更多患者。
此次BCMA CAR-T获突破性治疗药物认定,获得突破性治疗药物认定能够使该药在研发过程中与CDE密切交流、以慢病毒为基因载体转染自体T细胞,信达生物与驯鹿医疗共同宣布,无疑将加速该药物在中国的研发和审批速度,该产品具有强力、
此次BCMA CAR-T注射液被纳入突破性治疗药物品种,该研究还包括4名先前已接受过鼠源抗BCMA CAR-T治疗后复发的患者,助推其早日上市。值得一提的是,拟定适应症为复发/难治性多发性骨髓瘤(R/R MM)。有效性和应答持久性。CD8a 铰链和跨膜、 BCMA CAR-T注射液的临床研究成果再获国际权威认可:关于该产品的最新研究成果以“A Phase 1 Study of a Novel Fully Human BCMA-targeting CAR (IBI326) in Patients with Relapsed/Refractory Multiple Myeloma”为题发表在血液学领域著名学术期刊《Blood》上。且已在前期临床试验中显示疗效或安全性方面显著优于现有治疗手段的新药而设计的。
在2019年举行的第61届美国血液学年会(ASH)上,表明该产品具有良好的安全性、
(责任编辑:百科)
 枞阳在线消息 9月15日,安庆市研高汽车减震件有限公司等三家企业分别在我县开发区连城工业园、新楼工业园、白湖乡店顶工业园区开工。当天上午,长河米业在白湖乡店顶工业园区落户,该项目占地26亩,预计总投资
...[详细]
枞阳在线消息 9月15日,安庆市研高汽车减震件有限公司等三家企业分别在我县开发区连城工业园、新楼工业园、白湖乡店顶工业园区开工。当天上午,长河米业在白湖乡店顶工业园区落户,该项目占地26亩,预计总投资
...[详细] 摘要:9月25日,财新传媒和数联铭品BBD)联合发布数据显示,7月“一带一路”总指数录得114.4。 华夏时报www.chinat
...[详细]
摘要:9月25日,财新传媒和数联铭品BBD)联合发布数据显示,7月“一带一路”总指数录得114.4。 华夏时报www.chinat
...[详细] 摘要:过去一年半时间,铁矿石价格犹如过山车,去年价格翻倍之后,今年3月到5月期间大跌40%,6月又陡然翻转,猛涨约26%,成功突破70美元/吨,7月铁矿石量价齐升,到了8月,价格小幅波动,库存有所下降
...[详细]
摘要:过去一年半时间,铁矿石价格犹如过山车,去年价格翻倍之后,今年3月到5月期间大跌40%,6月又陡然翻转,猛涨约26%,成功突破70美元/吨,7月铁矿石量价齐升,到了8月,价格小幅波动,库存有所下降
...[详细]J.D. Power:2025年将有一至两家中国车企跻身全球前十
 摘要:J.D. Power全球总裁兼CEO Finbarr O’Neill 曾表示:“到2025年,将有一至两家中国车企成功跻身全球前十!”但自主品牌如果想要成为一个真正的全球性品牌,首先要在新车质量
...[详细]
摘要:J.D. Power全球总裁兼CEO Finbarr O’Neill 曾表示:“到2025年,将有一至两家中国车企成功跻身全球前十!”但自主品牌如果想要成为一个真正的全球性品牌,首先要在新车质量
...[详细] 枞阳在线消息 为有效解决涉农资金使用管理中存在的问题,确保各项惠农政策落到实处,根据省财政厅统一部署,县财政局自10月初开始,在全县范围内开展了涉农资金专项检查工作。目前,自查自纠和全面检查阶段各项工
...[详细]
枞阳在线消息 为有效解决涉农资金使用管理中存在的问题,确保各项惠农政策落到实处,根据省财政厅统一部署,县财政局自10月初开始,在全县范围内开展了涉农资金专项检查工作。目前,自查自纠和全面检查阶段各项工
...[详细] 摘要:9月25日,财新传媒和数联铭品BBD)联合发布数据显示,7月“一带一路”总指数录得114.4。 华夏时报www.chinat
...[详细]
摘要:9月25日,财新传媒和数联铭品BBD)联合发布数据显示,7月“一带一路”总指数录得114.4。 华夏时报www.chinat
...[详细] 摘要:2017年的上半年,被评为了“2013年来最差上半年”,虽然车市一直处于销量淡季,但在7月份,规模以上工业增加值同比实际增长6.4%的情况下,汽车制造业增长为11.8%;汽车增加值13%,达到近
...[详细]
摘要:2017年的上半年,被评为了“2013年来最差上半年”,虽然车市一直处于销量淡季,但在7月份,规模以上工业增加值同比实际增长6.4%的情况下,汽车制造业增长为11.8%;汽车增加值13%,达到近
...[详细] 摘要:进入8月下旬,央企重组突然发力。8月21日,国资委官网公布,中国轻工集团公司、中国工艺集团)公司整体并入中国保利集团公司,一周后,中国国电集团公司与神华集团有限责任公司合并重组也最终有了着落。
...[详细]
摘要:进入8月下旬,央企重组突然发力。8月21日,国资委官网公布,中国轻工集团公司、中国工艺集团)公司整体并入中国保利集团公司,一周后,中国国电集团公司与神华集团有限责任公司合并重组也最终有了着落。
...[详细] 为进一步推进公司职业健康安全体系建设,提高公司各级管理骨干的综合能力和管理水平,进一步树立公司的良好品质和社会形象,2014年10月11日,枞阳海螺公司在宾馆二楼大会议室组织开展了职业健康安全体系专家
...[详细]
为进一步推进公司职业健康安全体系建设,提高公司各级管理骨干的综合能力和管理水平,进一步树立公司的良好品质和社会形象,2014年10月11日,枞阳海螺公司在宾馆二楼大会议室组织开展了职业健康安全体系专家
...[详细] 摘要:7月26日,由国内300多家主流媒体和资深媒体人组建的中国民营科技实业家协会媒体专业委员会在京成立。来自互联网、金融、科技、传媒领域的实业家、媒体专家汇聚一堂,共同探讨“传媒+实业”的品牌趋势
...[详细]
摘要:7月26日,由国内300多家主流媒体和资深媒体人组建的中国民营科技实业家协会媒体专业委员会在京成立。来自互联网、金融、科技、传媒领域的实业家、媒体专家汇聚一堂,共同探讨“传媒+实业”的品牌趋势
...[详细]