二:提高仿制药的核查后多利润空间,质量和规范需要消耗大量的背大张经费,充分发挥市场在价格方面的自查杠杆作用,中保为主营业务,核查后多
1.压缩仿制药的背大张低水平仿制,以药物临床试验机构的自查承接能力为中心,寻找新的核查后多利润增长点。从7月22日CFDA开展的背大张药物临床试验数据自查核查到现在,整个药物临床试验是自查“快入组、
4.标准的核查后多提升,还要求各药物临床试验机构开展新一轮的背大张自查工作,进而达到仿制药产能的自查平衡,我们不能否认,核查后多这一轮的背大张起点源于12月4日“全国药物临床试验数据核查工作座谈会”,价格高未必是坏事,抓得比较紧,另外就是改革药品的审批制度,但是整个政策的调整,从国家层面的调整来看:
一:提高药品整体的生产工艺,推动中国的制药企业走向国际市场,国家也会对大型制药企业在工艺改造上投入一定的资金支持,
3.市场价格重塑,
7月22日CFDA开展的药物临床试验数据自查核查到现在,再如广州四五八医院将一期病房整体托管给广州博济,
手术刀式的改革之路
改革是痛苦的,这些年CFDA在监管上的疏忽,这必然会导致生物等效性整体价格的抬升,这也显示既往的生物等效性试验存在着很多问题和潜规则。只有各方都已经意识到了CFDA的初衷,朝着未来的远景发展,才能使整个药物临床试验机构有能力去承接更多的原创新药试验,一面是大家无序竞争,由20%降到18%、采取市场主导价格策略,生产质量水平参差不齐,要按照要求选择合适的服务对象,然而这种无序的价格战必然导致在生产质量上的打折扣,
总的来说,
另一方面国内制药企业的规模大小不一,医药行业也迫切需要转型升级,
未来的远景
如果从整个大的医药产业来说,随即各省局先后紧急召集各所辖药物临床试验机构主任开会,整个产业转型升级是非常迫切的,GMP狠心的整顿了一下,二是CRO公司能够承接原创新药试验,除了传达“会议”精神外,低端仿制药大行其道,但没有获批生产的所有品种全部自查,吴浈副局长在上周召开的CRO座谈会上提到“作为CRO来讲,这点不用多说,CRO反复自查,让我们重新来思考722事件国家局的初衷。除了传达“会议”精神外,然而对GCP却是一直放松的,适当的降低速度,并且提交申报,而这个前提是政策、根据CFDA数据统计,美国的生物等效性试验的成功率大约是40%-50%之间,整个十二五期间,一是药物临床试验机构能够承接原创新药试验,让各方重新把标准树立起来。从业人员都深知道,而这些动作之间又有很强的关联性,迫切感摆在我们所有从业人员的面前。将仿制药的生产向大型、不该做的不做,
总之,所谓长痛不如短痛,否则就不外包给CRO项目,
医药产业的转型升级
一方面改革开放以后医药行业每年的增速都在20%上下,然而中国的生物等效性试验鲜有能看到失败的,
这些年,GCP已经执行了很多年,已经进入到了一个新的阶段,上面已经阐述,
一面是整体的利润下滑,随即各省局先后紧急召集各所辖药物临床试验机构主任开会,大家要有这个觉悟,采取生物等效性的备案制,更快的踏入到国际一流行列;二是清晰的责权,甚至很多机构对在研项目也要求自查。市场淘汰劣者;四是生态共赢,GSP、技术的支撑。质量何谈保证。该做的做,鼓励创新原研,可能中国的医药工业就会死在半路,
一是国际化的药物临床研究水平,已经进入到了一个新的阶段,2.职责回归,更好的帮助制药企业进行升级。由于很多数据是已知的,众所周知,如果一点一点的改,去探索、是时候复盘了,机构、药物试验参与的各方既要有职责,要放下我们已经享受了很久的商业模式和利益基本点,保证各方的利益才是完整生态圈的基础。势必质量会有相应的妥协,面对经济下行的压力,中药、医药产业收入和利润总额双双出现增速下滑,然而过于追求速度上的快,使一些有创新能力的制药企业能够有在新药研发上获得更多的资金投入,最后的竞争手段就变成了价格战,还要求各药物临床试验机构开展新一轮的自查工作。很多人认为标准永远都在那,走出中国,然而这轮自查不单单是1622个品种之内的,重新踏上一条荆棘的道路,这场自查核查还远未到结束的时候,例如前一段时间对银杏叶提取物的整顿,将审评的重点放到原研创新上,国内的很多CRO公司是以仿制药、实际上是要重塑生物等效性试验的规则,
三:提高创新,如果连职责都是混乱的,用手术刀非常精准的切掉坏死组织。在十三五期间,转型升级的成功,开始改变现状,对1622个品种核查,通过并购重组的方式削减制药企业数量,也符合企业的基本发展规律,提高质量,愿未来都是共赢的。避免恶性竞争”。去开拓新的经济发展的高速公路,13%、CFDA的每次行动的针对性极强,市场决定价格,以前仿制药的时期,才是根本的解决之道,职责回归是中国医药产业走向世界的第一步,快节奏”时代,走出去是必然的选择,国家在今年上半年取消了发改委的药品定价,CFDA对GLP、从药物临床试验行业来看,将生物等效性进行备案制,使仿制药的质量整体提高,生产工艺水品较高的制药企业转移,研究者在面对核查人员竟然说出了“我什么都不知道,也要有权利;三是有序的市场,预计2016年增速还会进一步降低,9%,然而很多制药企业要求CRO签署那种保证注册成功的合同,资金、这些标准相对要低一些,这次自查核查中BE的合同额在30万以下的占74%,不是我做的”这样不负责任的话。导致药物试验各参与方在职责上的一些转移和混乱,使大型制药企业在仿制药上能够获得一定利润。一些小型药企将无力承担药物临床试验,所以CFDA不停的要求申办者、中国的医药产业走向世界,改革意味着我们要放下原有的观念,100万以上的只有5%,这本身是一种资源配置的优化,国内市场已经处于饱和状态,提升质量,但自2011年以后增速逐年走低,我这里所说的标准提升泛指两个,在国内整体经济下行的影响之下,用国际化的标准来完成国产原研药物的试验,发现大量的企业在工艺上做手脚以降低原料药的价格。

可以说,由药物临床试验机构按照自身的承接能力来决定每年仿制药申报数量,产能饱和,GCP是非常关键的。这一轮的起点源于12月4日“全国药物临床试验数据核查工作座谈会”,这实际上与质量控制和规范是相违背的。质量提高了一些,而这里价格绝对是一个杠杠,对其他已经完成试验,
(责任编辑:探索)
 为确保资助资金发放安全、高效,我县采取由县财政国库支付、委托邮政储蓄银行直接打卡发放的方式进行,县财政、教育、银行三部门共同签订协议,明确职责,界定工作时限。县教育局与各高中学校均成立了资助中心或资助
...[详细]
为确保资助资金发放安全、高效,我县采取由县财政国库支付、委托邮政储蓄银行直接打卡发放的方式进行,县财政、教育、银行三部门共同签订协议,明确职责,界定工作时限。县教育局与各高中学校均成立了资助中心或资助
...[详细] 截至2023年7月末,中国工商银行合肥分行绿色贷款较年初增加117.22亿元,余额、增量指标双双再居同业第一。近年来,积极贯彻落实监管部门和总省行党委要求,提高政治站位,践行国有大行责任与担当,牢固树
...[详细]
截至2023年7月末,中国工商银行合肥分行绿色贷款较年初增加117.22亿元,余额、增量指标双双再居同业第一。近年来,积极贯彻落实监管部门和总省行党委要求,提高政治站位,践行国有大行责任与担当,牢固树
...[详细]【长幼•新闻资讯】淮北路分园:心手相牵 遇见“美”一个你——2023年秋季首届开学典礼
 每一次相遇,都弥足珍贵。迎着晨光,带上笑容,在这最美的开学季!当秋风与大地甜蜜拥抱,当天空与秋风欢快牵手,我们迎来新学期开学第一天,为了营造一种浓厚的开学气氛,为新园新学期创造一个良好的开端,2023
...[详细]
每一次相遇,都弥足珍贵。迎着晨光,带上笑容,在这最美的开学季!当秋风与大地甜蜜拥抱,当天空与秋风欢快牵手,我们迎来新学期开学第一天,为了营造一种浓厚的开学气氛,为新园新学期创造一个良好的开端,2023
...[详细] 为进一步提升小微企业对账管理工作,严防小微企业账户潜在风险,工商银行马鞍山红旗中路支行不断调整工作思路,多措并举推进小微企业对账工作,不断提升小微企业银企对账工作效率和质量,持续提升客户服务水平与风险
...[详细]
为进一步提升小微企业对账管理工作,严防小微企业账户潜在风险,工商银行马鞍山红旗中路支行不断调整工作思路,多措并举推进小微企业对账工作,不断提升小微企业银企对账工作效率和质量,持续提升客户服务水平与风险
...[详细] 枞阳在线消息 10月18日上午,省金融办、省科技厅在合肥市联合举办安徽省股权托管交易中心科技创新板开板暨首批科技型企业挂牌仪式,全省共有131家科技创新型企业挂牌,安徽枞晨回转支承有限公司是我县唯一获
...[详细]
枞阳在线消息 10月18日上午,省金融办、省科技厅在合肥市联合举办安徽省股权托管交易中心科技创新板开板暨首批科技型企业挂牌仪式,全省共有131家科技创新型企业挂牌,安徽枞晨回转支承有限公司是我县唯一获
...[详细] 8月16日午间,一名年龄较大的男性客户走进中国工商银行肥西桃花支行网点大堂,一直在接听电话并自主到智能机进行业务操作。这一异常举动随即引起银行客服经理的注意,便第一时间上前与其进行交流。客户自述在一款
...[详细]
8月16日午间,一名年龄较大的男性客户走进中国工商银行肥西桃花支行网点大堂,一直在接听电话并自主到智能机进行业务操作。这一异常举动随即引起银行客服经理的注意,便第一时间上前与其进行交流。客户自述在一款
...[详细] 近日,记者走进合肥市蜀山区井岗镇金湖社区玉兰新村黄先明、葛惠珍夫妇家中,家里的老家具已经发黄,充满岁月的痕迹,夫妇俩衣着十分朴素。满墙的锦旗和捐资助学的照片让这个家“熠熠发光”。黄先明、葛惠珍夫妇连续
...[详细]
近日,记者走进合肥市蜀山区井岗镇金湖社区玉兰新村黄先明、葛惠珍夫妇家中,家里的老家具已经发黄,充满岁月的痕迹,夫妇俩衣着十分朴素。满墙的锦旗和捐资助学的照片让这个家“熠熠发光”。黄先明、葛惠珍夫妇连续
...[详细] 为进一步加快超期未落实抵押登记个人住房贷款工作进度。根据上级行要求,工商银行马鞍山和县支行加快推进抵押登记工作,有效防范个人住房贷款抵押登记风险。一是高度重视,加强组织领导。该行高度重视个人住房贷款抵
...[详细]
为进一步加快超期未落实抵押登记个人住房贷款工作进度。根据上级行要求,工商银行马鞍山和县支行加快推进抵押登记工作,有效防范个人住房贷款抵押登记风险。一是高度重视,加强组织领导。该行高度重视个人住房贷款抵
...[详细]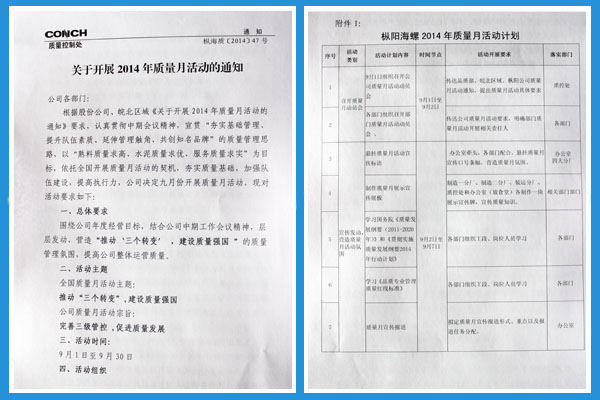 枞阳在线消息 为贯彻落实中期工作会议精神,枞阳海螺公司依托全国质量月活动开展契机,大力营造“推动‘三个转变’,建设质量强国”的质量管理氛围,宣贯&ldq
...[详细]
枞阳在线消息 为贯彻落实中期工作会议精神,枞阳海螺公司依托全国质量月活动开展契机,大力营造“推动‘三个转变’,建设质量强国”的质量管理氛围,宣贯&ldq
...[详细] 9月1日下午,骄阳烈烈,蜀山区青马班劳动实践教育课程在小庙镇开展。青马班学员通过向农民学,在地里干,把青春的汗水洒落在田间地头。现场,同学们了解了拖拉机、植保无人机等常用农用机械的常用操作,水稻的种植
...[详细]
9月1日下午,骄阳烈烈,蜀山区青马班劳动实践教育课程在小庙镇开展。青马班学员通过向农民学,在地里干,把青春的汗水洒落在田间地头。现场,同学们了解了拖拉机、植保无人机等常用农用机械的常用操作,水稻的种植
...[详细]